Arbeitsgruppe Molekulare Kardiologie
Fokus Endocannabinoidsystem
Entzündliche Effekte im Rahmen der Bildung atherosklerotischer Läsionen werden durch Zellen des angeborenen und des adaptiven Immunsystems, sowie durch Endothelzellen vermittelt. Das Endocannabinoidsystem (ECS), welches sowohl von Immunzellen als auch von Endothelzellen exprimiert wird, ist dabei von Bedeutung für die Regulation dieser entzündlichen Mechanismen.
Das ECS besteht aus den beiden Cannabinoidrezeptoren 1 und 2 (CB1, CB2), sowie einem dritten, ebenfalls G-Protein-gekoppelten Rezeptor, GPR 55. Der Klonierung der CB-Rezeptoren folgte die Entdeckung deren endogener Liganden Arachidonylethanolamid (AEA, Anandamid) und 2-Arachidonylglycerol (2-AG), sowie der Liganden-synthetisierenden und -abbauenden Enzyme.
In verschiedenen Publikationen konnten wir nachweisen, dass der CB1 Rezeptor atherogene Effekte vermittelt, während der CB2 Rezeptor atheroprotektiv wirkt. Besonders interessant ist daher die Wirkungsweise der körpereigenen Cannabinoide, welche Liganden beider CB-Rezeptoren darstellen. In rezenten Publikationen konnten wir den beiden körpereigenen Cannabinoiden, AEA und 2-AG, eine atherogene Wirkung attestieren. Unser Augenmerk gilt nun der Erforschung der zugrunde liegenden Mechanismen. Darüber hinaus untersuchen wir den Stellenwert der Endocannabinoide in Diagnostik und Therapie bei kardiovaskulär erkrankten Patienten. Basierend auf einem besseren Verständnis der komplexen Interaktionen des Endocannabinoidsystems streben wir nach der Identifikation neuer therapeutischer Ansatzpunkte.
Thematische Schwerpunkte
Endocannabinoidsystem – Vaskuläre Inflammation – Atherogenese – Endotheliale Dysfunktion – Endotheliale Regeneration (Molekularbiologie, Tiermodelle, klinische Studien)
- Vaskluäre Inflammation, Endocannabinoidsystem
- Endotheliale Apoptose, Endothelfunktion, Atherosklerose
- Regulation der Proliferation glatter Gefäßmuskelzellen und Endothelzellen
- Vaskuläre Reparaturmechanismen
- Proinflammatorische Zytokine und vaskuläre Zellen
- Vaskulärer oxidativer Stress, beteiligte Enzymsysteme
Mitglieder und Kontakte
Dr. med. Julian Jehle
E-Mail: Julian.Jehle@ukbonn.de
Publikationen: www.ncbi.nlm.nih.gov
Prof. Dr. med. Georg Nickenig
E-Mail: Georg.Nickenig@ukbonn.de
Publikationen: www.ncbi.nlm.nih.gov
Kooperationspartner
- Prof. Dr. rer. nat. A. Zimmer, Institut für Molekulare Psychiatrie, Universität Bonn
- Prof. Dr. rer. nat. B. Lutz, Institut für Physiologische Chemie, Universität Mainz
- Prof. Dr. med. G. Hartmann, Institut für Klinische Chemie und Klinische Pharmakologie, Universität Bonn
- Prof. Dr. med. V. Hornung, Institut für Klinische Chemie und Klinische Pharmakologie, Universität Bonn
- Prof. Dr. med. E. Latz, Institut für Angeborene Immunität, Universität Bonn
- Prof. Dr. med. B. Fleischmann, Institut für Physiologie I, Universität Bonn
- uvm.
AG Vaskuläre Inflammation und ER Stress
AG Vaskuläre Inflammation und ER Stress
Kardiovaskuläre Erkrankungen wie die koronare Herzerkrankung oder die Aortenklappenstenose sind gekennzeichnet durch chronische inflammatorische Prozesse. In den letzten Jahren konnte mittels großer randomisierter Studien erstmalig bewiesen werden, dass anti-inflammatorisch wirksame Medikamente den Progress von kardiovaskulären Erkrankungen positiv beeinflussen.
Vaskuläre Inflammation verhindert unter anderem die korrekte Proteinfaltung im endoplasmatischen Retikulum (ER). Dies führt zu Akkumulation fehlgefalteter Proteine („ER Stress“) und schließlich zu zellulärer Dysfunktion und einem Progress der inflammatorischen Erkrankungen. Eine entscheidende Rolle von ER Stress und der hierdurch aktivierten sogenannten unfolded protein response (UPR) in der Pathogenese kardiovaskulärer Erkrankungen ist durch zahlreiche Publikationen dokumentiert.
Im Fokus unserer Arbeitsgruppe steht die Untersuchung und Charakterisierung von vaskulärer Inflammation und hierbei vor allem von ER Stress und ER Stress-induzierten Signalwegen. Mit Hilfe von Zellkultur- und Tiermodellen sowie klinischen Studien untersuchen wir den Stellenwert und mögliche Ansatzpunkte zur Modifikation und Therapie von kardiovaskulärem ER Stress.
Schwerpunkte
Experimentell:
- Rolle von extrazellulären Chaperonen wie GRP78 (glucose-regulated Protein, 78kDa) als interzelluläre Mediatoren der endothelialen Dysfunktion
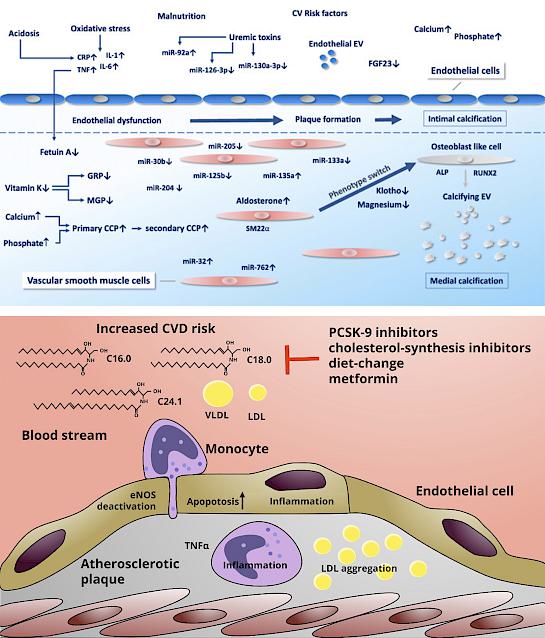
- Kalzifizierung und Phänotyp-Switch glatter Gefäßmuskelzellen
- Rolle von Vitamin K und der Vitamin-K-Epoxidase-Reduktasen (VKORC1 und VKORC1L1) in der vaskulären Inflammation und ER Stress
- Relevanz der mitochondrialen unfolded protein response in der Atherogenese und endothelialen Dysfunktion
- Rolle von ER Stress und des GRP78 in der Pulmonal-arteriellen Hypertonie
- Rolle von Inflammation und ER Stress in der mikrovaskulären Dysfunktion
Klinisch-Experimentell:
- Zirkulierende Chaperone als diagnostische und prognostische Biomarker bei PatientInnen mit KHK und Aortenklappenstenose
- Zirkulierende Chaperone als diagnostische und prognostische Biomarker bei PatientInnen mit Pulmonal-arterieller Hypertonie.
- Kinetik und Relevanz von Chaperon-Proteinen bei PatienInnen im kardiogenen Schock
Mitglieder und Kontakte
Dr. med. Adem Aksoy
E-Mail: Adem.Aksoy@ukbonn.de
Dr. med. Muntadher Al Zaidi
E-Mail: Muntadher.Al_Zaidi@ukbonn.de
Publikationen: www.ncbi.nlm.nih.gov
- Cand. med. Elena Repges (Doktorandin)
- Cand. med. Justus Eschweiler (Doktorand)
- Cand. med. Natalie Clausen (Doktorandin)
- Annika Basche (Biologisch Technische Assistentin)
Förderung
- BONFOR
- Sci-Med-Programm
- Deutsche Herzstiftung
AG Endotheliale Regeneration, Fokus Vaskuläre Interzelluläre Kommunikation
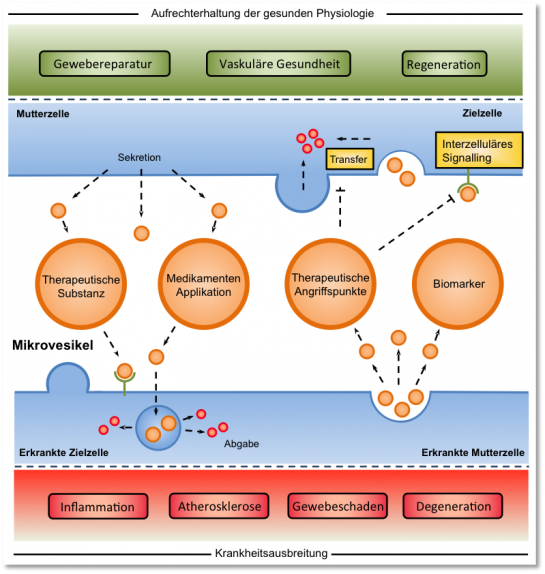
Zelluläre Mikrovesikel stellen zentrale Regulatoren der kardiovaskulären Gesundheit und Krankheitsentstehung dar. Ihre genaue Rolle bei der Genese, Progression und Regeneration kardiovaskulärer Erkrankungen wie der Atherosklerose ist bisher wenig untersucht. In drei Forschungsschwerpunkten untersuchen wir grundlagenwissenschaftlich die Biogenese und zelluläre Wirkung, translational das präklinische therapeutische Potential und klinisch die Bedeutung von Mikrovesikeln bei Patienten. Fachgebiet-übergreifende Kooperationen ermöglichen eine transdisziplinäre Aufarbeitung (patho-)physiologischer, interzellulärer Kommunikationsmechanismen, die als Grundlage für die Entwicklung neuer Therapieoptionen zur Behandlung degenerativer kardiovaskulärer Erkrankungen dienen könnten.
Thematische Schwerpunkte
Endotheliale Dysfunktion – Endotheliale Regeneration – vaskuläre Inflammation – Atherogenese – (Molekularbiologie, Tiermodelle, klinische Studien)
Grundlagenwissenschaftliche Schwerpunkte
- Screening von biologischen Inhalten extrazellulärer Vesikel (EVs)
- Einfluss von atherogenen Konditionen (Hypercholesterinämie, Diabetes mellitus, oxidativer Stress) auf biologischen Inhalt und Funktion von EVs
- Exploration von Sorting- und Verpackungsmechanismen zellulärer Bestandteile in EVs
- Interzelluläre Kommunikationsmechanismen durch EV-vermittelten horizontalen Gentransfer
- Rolle und Funktion von microRNAs und long non-coding RNAs in EVs
- Einfluss von EVs auf Proliferation und Phänotyp glatter Gefäßmuskelzellen und Endothelzellen
- Einfluss der Inflammasom-Aktivierung auf Inhalt und Funktion von EVs
- Untersuchung des therapeutischen Potentials genetisch modifizierter EVs
Klinische Schwerpunkte
- EVs als Biomarker bei Patienten mit koronarer Herzerkrankung
- Freisetzungskinetik von EVs und microRNAs bei Patienten mit koronarer Herzerkrankung nach kardialem Stress
- Expressionsprofil zirkulierender microRNAs bei Patienten mit koronarer Herzerkrankung und Diabetes mellitus Typ II
- Zirkulierende microRNAs als diagnostischer und prognostischer Marker bei Patienten mit koronarer Herzerkrankung
- EVs und zirkulierende microRNAs als Biomarker bei Patienten mit hochgradiger Aortenklappenstenose
Mitglieder und Kontakte
Priv.-Doz. Dr. med. Felix Jansen
E-mail: Felix.Jansen@ukbonn.de
Publikationen: www.ncbi.nlm.nih.gov
Wissenschaftliche Mitarbeiter
- Dr. rer. nat. Mohammed Rabiul Hosen,
- Dr. med. Philipp Pfeifer, Assistenzarzt
- Priv.-Doz. Dr. med. Andreas Zietzer, Facharzt
- Dr. med. Philip Goody, Facharzt
- Dr. med. Tobias Stumpf, Assistenzarzt
- Ansgar Nils Ackerschott, Assistenzarzt
- Anna Flender, MTA
- Cand. med. Han Wang
- Cand. med. Yangyang Liu
- Cand. med. Martin Dombrowski
- Cand. med. Lisa Schäfer
- Cand. med. David Pinsdorf
- Cand. med. Qian Li
- Cand. med. Xu Xiang
Regionale/ nationale Kooperationen
- Rheinische Friedrich Wilhelms-Universität Bonn:
- Prof. Dr. Pfeifer, J. Beuel: Institut für Pharmakologie und Toxikologie
- Prof. Dr. Latz, Dr. Franklin: Institut für angeborene Immunität
- Prof. Dr. Fleischmann, Dr. Wenzel: Institut für kardiovaskuläre Physiologie
- Prof. Gieselmann, Dr. Sylvester: Institut für Biochemie und Molekularbiologie
- Dr. Lars Eichhorn: Klinik für Anästhesiologie und operative Intensivmedizin
- Prof. Dr. Bloch, Dr. Wahl: Sporthochschule Köln
Internationale Kooperationen
- Dr. Yang, MD, PhD, Feinberg Cardiovascular Research Institute, Northwestern Universtity Chicaco, USA
AG Kardiovaskuläre Immunologie, Fokus Angeborene Immunologie
Im Fokus der Arbeitsgruppe steht die Erforschung der Pathogenese und Therapie der Atherosklerose, unter Zuhilfenahme zellbiologischer, molekularbiologischer, tierexperimenteller und klinisch-experimenteller Methoden.
Schwerpunkte sind hierbei die Erforschung und Therapie der vaskulären Inflammation im Allgemeinen und des NLRP3-Inflammasoms als Bestandteil des angeborenen Immunsystems im Speziellen, sowie die endotheliale Dysfunktion und die Rolle von Cholesterinkristallen im Prozess der Atherogenese.
Ein Schwerpunkt der klinischen Forschung ist zum einen die Übertragung von zellkultur- und tierexperimentell gewonnenen Befunden auf den Menschen. Zum anderen wird der Einfluss und die prognostische Bedeutung zellulärer Biomarker bei Patienten/-innen mit Herz-Kreislauferkrankungen untersucht.
Thematische Schwerpunkte
Vaskuläre Inflammation – Atherogenese – Endotheliale Dysfunktion – Endotheliale Regeneration (Molekularbiologie, Tiermodelle, klinische Studien)
- Vaskluäre Inflammation, NLRP3-Inflammasom
- Nukleinsäure Rezeptoren und Entzündungsreaktion bei Gefäßverletzung
- Inflammasom-induzierte interzelluläre Signaltransduktion durch Mikropartikel
- Die Rolle des CLEC4E-Rezeptors in der Atherogenese
- Cholesterinkristalle und deren Auflösungskapazität durch humanes Serum
- Endotheliale Progenitorzellen und kardiale Funktion
- Endotheliale Apoptose, Endothelfunktion, Atherosklerose
- Vaskulärer oxidativer Stress, beteiligte Enzymsysteme, Endothelfunktion, Atherosklerose
- Renin-Angiotensin-System, AT1-Rezeptor-Regulation, Endothelfunktion, Atherosklerose, metabolisches Syndrom
- Regulation der Proliferation glatter Gefäßmuskelzellen und Endothelzellen
- Proinflammatorische Zytokine und vaskuläre Zellen
- Vaskuläre Effekte von HMG-CoA-Reduktase-Inhibitoren (Statinen)
- Lipoproteine und vaskuläre Zellen
Mitglieder und Kontakte
Univ.-Prof. Dr. med. Sebastian Zimmer
E-Mail: Sebastian.Zimmer@ukbonn.de
Publikationen: www.ncbi.nlm.nih.gov
- Dr. rer. nat. Sandra Adler
- Dr. vet. nat. Marta Stei
- Dr. med. Thorsten Mahn, Assistenzarzt
- Dr. med. Sven Thomas Niepmann, Assistenzarzt
- Dr. med. Philipp Pfeiffer, Assistenzarzt
- Dr. med. Johanna Vogelhuber, Assistenzärztin
- Dr. med. Nikola Lübbering, Assistenzärztin
- Dr. med. Marko Bulic, Assistenzarzt
- Dr. med. Hannah Billig, Assistenzarzt
- Dr. med. Eva Steffen, Assistenzarzt
- Dr. med. Felix Overhoff, Assistenzarzt
- Dr. med. Julian Jehle, Oberarzt
- Dr. med. Moritz Nöthel, Assistenzarzt
- Gloria Martinac (TA)
- Pia Fuchs (TA)
- Henning Panatzek (TA)
- Christoph Schwelle (TA)
- Nicola Willemsen (PhD-Studentin)
Fokus Aorten- und Aortenklappenerkrankungen
Im Fokus der Nachwuchsgruppe steht die Pathogenese und Therapie der Atherosklerose der thorakalen und abdominellen Aorta, des abdominellen Aortenaneurysmas und der degenerativen Aortenklappenstenose im Kleintiermodell. Schwerpunkte sind die Erforschung der vaskulären und valvulären Inflammation mit Blick auf angeborene und erworbene Immunität und die Immuntherapie durch experimentelle Ansätze. Die erhobenen Daten werden in Patientenkohorten i.S. eines translationalen Ansatzes überprüft.
Thematische Schwerpunkte
Atherogenese der thorakalen und abdominellen Aorta – Degenerative Aortenklappenstenose – Abdominelles Aortenaneurysma – Monozyten – T und B Lymphozyten – Immunmodulatorische Therapie
Mitglieder und Kontakte
Univ.-Prof. Dr. med. Sebastian Zimmer
E-Mail: Sebastian.Zimmer@ukbonn.de
Publikationen: www.ncbi.nlm.nih.gov
- Dr. rer. nat. Sandra Adler
- Dr. vet. nat. Marta Stei
- Dr. med. Thorsten Mahn, Assistenzarzt
- Dr. med. Sven Thomas Niepmann, Assistenzarzt
- Dr. med. Philipp Pfeiffer, Assistenzarzt
- Dr. med. Johanna Vogelhuber, Assistenzärztin
- Dr. med. Nikola Lübbering, Assistenzärztin
- Dr. med. Marko Bulic, Assistenzarzt
- Dr. med. Hannah Billig, Assistenzarzt
- Dr. med. Eva Steffen, Assistenzarzt
- Dr. med. Felix Overhoff, Assistenzarzt
- Dr. med. Julian Jehle, Oberarzt
- Dr. med. Moritz Nöthel, Assistenzarzt
- Gloria Martinac (TA)
- Pia Fuchs (TA)
- Henning Panatzek (TA)
- Christoph Schwelle (TA)
- Nicola Willemsen (PhD-Studentin)
AG: Cardiovascular epigenetics, RNA Biology, and RNA-therapeutics
Cardiovascular disease (CVD) remains the leading cause of mortality in the world, despite the recent development of highly effective medical treatments and well-tolerated therapeutic interventions. This means that the currently used diagnostic and therapeutic methods for CVD (biomarkers, drugs, coronary stents) have already fulfilled their potential for improving health and might not have a further impact on the treatment of CVD. As the number of patients and costs associated with CVD is continuing to increase in modern society, there is an urgent need for novel diagnostic and therapeutic options for CVD. Despite this dismaying scenario, the recent discovery of an entirely new mechanism that regulates the development of CVD, which involves extracellular vesicles (EVs), gives new hope for innovative diagnosis and treatment options for the disease. Over the years, we developed molecular techniques and strategies to reveal that the cell-cell cross talks via extracellular vesicular (EV)-ncRNAs play a crucial role in the regulation of CV health and disease. We demonstrated that endothelial cell (EC)-derived EVs prevent apoptosis in their target ECs and promote vascular regeneration by transferring functional miRNA-92a or lncRNA PUNISHER into recipient cells. Importantly, we observed that the biological effect of EVs depends primarily on their intravesicular ncRNA expression profile. The specific research focuses of our group:
- Cellular crosstalk and liquid biopsies in cardiovascular disease
- Epigenetic regulation by noncoding RNAs in cardiovascular disease.
- RNA therapeutics in cardiovascular disease
1. Cellular crosstalk and liquid biopsies in cardiovascular disease
Multifactorial CVDs, for instance, aortic stenosis (AS) has been characterized as a tightly regulated chronic inflammatory disease that leads to progressive fibrosis and calcification of the valve cusps with consecutive obstruction of blood flow through the aortic valve (AV). There is evidence that cellular crosstalk occurs in the diseased valve, where detrimental factors acting on the endothelial cell layer and paracrine factors secreted by infiltrating immune cells can be conveyed to other cell types in the valve (valvular interstitial cells, VICs) and stimulate osteoblastic differentiation and calcification of the valve tissue. Healthy and diseased cells are able to secrete extracellular vesicles (EVs) into the extracellular space and circulation. These EVs transport cargoes [proteins, cytokines, mRNAs, and noncoding RNAs (ncRNAs)], which can be taken up by target cells to exert their biological (negative or beneficial) effects.
EVs are small membrane-bound vesicles, which are released from cells into circulation. There are two major subtypes of EVs consisting of microvesicles (MVs) and exosomes. MVs are larger (>150 nm in diameter) vesicles that are released by budding from the plasma membrane, whereas exosomes are smaller (30 to 100 nm) and originate from the endosome. Injury to the endothelial layer of the arteries, which is the initial and crucial step in the development of atherosclerosis, triggers the release of EVs. Accordingly, cardiovascular diseases, such as coronary artery disease (CAD), are associated with systemic endothelial damage and show significantly increased levels of circulating EVs. Because of their presence in most bodily fluids, EVs are easily accessible and have good potential as biomarkers for CVD [(atherosclerosis, CAD, calcific aortic stenosis (CAVD), etc]. Given that the biological contents of EVs contain a specific signature of cellular injury, EVs could become a unique tool for diagnosing and monitoring CVD (known as “liquid biopsy”).
Accordingly, we recently demonstrated that high levels of circulating EV-bound miR-122-5p were associated with a lack of improvement of left ventricle (LV) function and poor outcome in patients suffering from aortic stenosis and treated with transaortic interventional valve replacement (TAVR). The study has been published by top-tier cardiovascular journal, Circulation (https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.122.060258).
2. Epigenetic regulation by noncoding RNAs in cardiovascular disease.
Epigenetic regulators play a major role in the development and progression of AS in men and women, whereas ncRNAs are crucial to regulating epigenetic phenomena in the aging population. DNA methylation, histone modification, RNA modification or editing, and ncRNA-mediated mechanisms during CVD development are major epigenetic modulators. LncRNAs can act as chromatin activators or silencers to control epigenetic gene regulatory mechanisms, and our recent RNA-seq data revealed that circulating (EV-incorporated) plasma lncRNAs H19, AGAP2-AS1, GAS5, and AIRN and intercellular lncRNAs (e.g. KCNQ1OT1, PELATON, HIF1A-AS1) isolated from tissue explants of aortic stenosis patients are highly dysregulated. We are currently investigating the causal impacts of these molecules in context of the pathogenicity of aortic stenosis and other cardiovascular diseases [e.g. atherosclerosis, coronary artery disease (CAD)], which are major focuses of our group in association with Project B04 [https://www.trr259.uni-bonn.de/en/projects/b04] [Project-ID 397484323 – TRR 259 (Project B04)].
3. RNA therapeutics in cardiovascular disease
NcRNAs make up the vast majority of the human transcriptome (>70%) and are of crucial importance in regulating vascular homeostasis and disease development. NcRNAs do not code for and are not further translated into proteins, but instead regulate cellular functions through post-transcriptional and epigenetic regulation of gene expression. Probably the best-described subspecies of ncRNAs are microRNAs (miRNAs), which regulate gene expression at the post-transcriptional level by promoting the degradation of their cognate mRNAs and inhibiting translation. Another subspecies, long non-coding RNAs (lncRNAs; ncRNAs more than 200 nt in length), have recently gained a lot of interest because of their crucial role as biological regulators.
LncRNAs can modulate both the transcriptome and proteome of a cell by inducing epigenetic changes, by regulating alternative splicing, or by acting as endogenous molecular sponges. During the last decades, a growing list of lncRNAs has been discovered that plays a critical role in the development and pathophysiology of CVDs, including hypertension, CAD, myocardial infarction, ischemia, aortic valve stenosis (AS), and heart failure (HF). However, EV-encapsulated ncRNAs, which are released by different cell types under different pathological conditions, are still poorly investigated in the pathogenesis of CVD. NcRNAs [mainly microRNAs (miRNA), circular RNAs (circRNA), and long ncRNA (lncRNAs)] are well-known regulators of gene expression, and changes in their levels can modify phenotypes and cellular behavior and present an attractive target for RNA-based therapeutics.
Group leader
Dr. rer. nat. M. Rabiul Hosen, PhD
Independent Group Leader, Molecular Cardiology, Heart Center Bonn
Email: hosenmr@uni-bonn.de
Rabiul.hosen@ukbonn.de
https://www.trr259.uni-bonn.de
https://www.herzzentrum-bonn.de/
Publication: https://scholar.google.co.in/scholar?hl=en&as_sdt=0%2C5&q=hosen+mr&btnG=
Lab members:
PhD student:
Ms. Katharina Maus, M.Sc
BTA/MTA:
Ms. Anna Flender, BTA
Ms. Sarah Arahouan, BTA
MD Students:
Dr. med. Monika Baumschabl
Ms. Ling Zhou
Ms. Yujia Zhang
Ms. Zhexi Li
Mr. Yuan Zhou
Alumini:
Dr. med. Xu Xiang
Dr. med. Qian Li
Dr. med. Atur Illie
Dr. med. Yangyang Liu
Funding Organisations:
Deutsche Gesellschaft für Kardiologie (DGK)
Deutsche Herzstiftung e.V.
Ernst und Berta Grimmke Stiftung
Boehringer Ingelheim Foundation - BI-Stiftung
Corona Stiftung
German Research Foundation (DFG)
Internal collaboration (University of Bonn):
Dr. Mona Malek Mohammadi, Dr. Sarah Rieck, Prof. Dr. Fleischmann (Institute for Physiology),
Dr. Staffan Hildebrand, Prof. Dr. Alexander Pfeifer (Institute for Pharmacology and Toxicology)
Prof. Dr. Farhad Baktiary (Department for Heart Surgery)
Prof. Dr. Bernardo Franklin, Prof. Dr. Eicke Latz (Institute for Innate Immunity)
Prof. Dr. Kerstin Welhelm-Jüngling (Endothelial Metabolism, Inst. Cardiovascular Science)
Prof. Dr. Kathrin Leppek (Clinical Chemistry and Clinical Pharmacology)
Dr. Marc Sylvester (Core Facility Mass Spectrometry, Medical Faculty)
Dr. Heimbach (Institute of Human Genetics, NGS core facility)
Prof. Dr. med. Sebastian Zimmer, PD. Dr. med. Felix Jansen, Dr. med. Philip Goody, Dr. med. Andreas Zietzer, Dr. med. Adem Aksoy, Dr. med. Baravan Al-Kassou (Heart Center Bonn)
External collaboration (International and national):
Prof. Dr. Steven P. Jones (Diabetes and Obesity Center, University of Louisville, KY, USA)
Prof. Dr. Joseph B. Moore (Department of Medicine, The Christina Lee Brown Environment Institute, University of Louisville, KY, USA)
Prof. Dr. Shizuka Uchida (University of Aalborg, Copenhagen, Denmark)
Prof. Dr. Wenzel (System Biology, University of Bochum)
Dr. Ramesh Chennupati, Prof. Dr. Dr. med. Christian Jung (Cardiology, Pneumonology and Angiology, University Hospital Düsseldorf)
Dr. Giuseppe Militello (Yale University, CT, USA)
Dr. Tyler Weirick (RIKEN Institute, Japan)
Prof. Dr. Reinier Boon (Department of Physiology, VU University Medical Center, Amsterdam, the Netherlands)
Prof. Dr. Stefanie Dimmeler (Institute for Cardiovascular Regeneration, University of Frankfurt)
Most recent publications (selected 15 publications):
Hosen, M.R*#§., Goody, P.R., Zietzer, A., Xiang, X., Niepmann, S.T., Sedaghat, A., Tiyerili, V., Chennupati, R., Moore IV, J.B., Boon, R.A. and Uchida, S., 2022. Circulating microRNA-122-5p is associated with a lack of improvement in left ventricular function after transcatheter aortic valve replacement and regulates viability of cardiomyocytes through extracellular vesicles. Circulation, 146(24), pp.1836-1854. IF. 39.918 (2022).
Goody PR, Christmann D, Goody D, Nehl D, Backer K, Wilhelm-Juengling K, Uchida S, Moore JB, Zimmer S, Bakhtiary F, Pfeifer A, Latz E, Nickenig G, Jansen F, Hosen MR§. Aortic valve disease augments vesicular microRNA-145-5p to regulate the calcification of valvular interstitial cells via cellular crosstalk. bioRxiv 2022:2022.11.29.518326. doi:10.1101/2022.11.29.518326.
Nehl D, Goody PR, Maus K, Pfeifer A, Aikawa E, Bakhtiary F, Zimmer S, Nickenig G, Jansen F, Hosen MR§. Porcine and human aortic valve endothelial and interstitial cell isolation and characterization. bioRxiv 2022:2022.12.01.518669. doi:10.1101/2022.12.01.518669.
Hosen, M.R*#§., Li, Q., Liu, Y., Zietzer, A., Maus, K., Goody, P., Uchida, S., Latz, E., Werner, N., Nickenig, G. and Jansen, F., 2021. Coronary Artery Disease Increases the Long Noncoding RNA PUNISHER in Small Extracellular Vesicles and Regulates Endothelial Cell Function via Vesicular Shuttling. Molecular Therapy-Nucleic Acids. IF. 12.762 (2021).
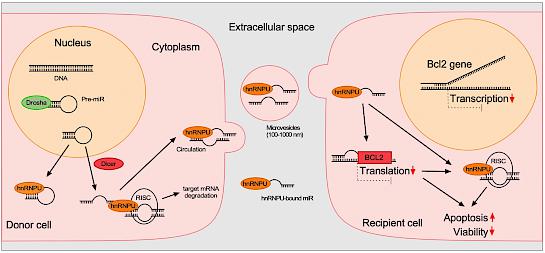
Zietzer, A*., Hosen, M.R*., Wang, H., Goody, P.R., Sylvester, M., Latz, E., Nickenig, G., Werner, N. and Jansen, F§., 2020. The RNA-binding protein hnRNPU regulates the sorting of microRNA-30c-5p into large extracellular vesicles. Journal of Extracellular Vesicles, 9(1), p.1786967. IF. 25.976 (2020).
Hosen, M.R*., Goody, P.R., Zietzer, A., Nickenig, G. and Jansen, F., 2020. MicroRNAs as master regulators of atherosclerosis: from pathogenesis to novel therapeutic options. Antioxidants and Redox Signaling, (ja). IF. 8.423 (2020).
Liu Y, Li Q, Hosen, M.R#, Zietzer A, Flender A, Levermann P, Schmitz T, Frühwald D, Goody P, Nickenig G, Werner N, Jansen F§. Atherosclerotic Conditions Promote the Packaging of Functional MicroRNA-92a-3p Into Endothelial Microvesicles. Circulation Research. 2019;124:575–587. IF. 15.211 (2019).
Goody, P.R., Hosen, M.R., Christmann, D., Niepmann, S.T., Zietzer, A., Adam, M., Bönner, F., Zimmer, S., Nickenig, G. and Jansen, F., 2020. Aortic valve stenosis: from basic mechanisms to novel therapeutic targets. Arteriosclerosis, Thrombosis, and Vascular Biology, 40(4), pp.885-900. IF. 8.604 (2020).
Zietzer, A., Steffen, E., Niepmann, S., Hosen, M.R., Liu, W., Jamme, P., Al-Kassou, B., Goody, P.R., Zimmer, S. and Reiners, K.S., 2020. MicroRNA-mediated vascular intercellular communication is altered in chronic kidney disease. Cardiovascular research. IF. 14.762 (2022).
Düsing, P., Zietzer, A., Hosen, M.R., Kurts, C., Nickenig, G. and Jansen, F., 2021. Vascular pathologies in chronic kidney disease: pathophysiological mechanisms and novel therapeutic approaches. Journal of Molecular Medicine, pp.1-14. IF. 5.40 (2020).
Goody PR*., Hosen M.R*#., Christmann D., Goody D., Flender A., Levermann P., Nickenig G., Werner N., Pfeifer A., Jansen F.; Extracellular vesicles as intercellular messengers in aortic valve calcification, in major revision (2022).
Goody, P.R., Nachtsheim, L., Hosen, M.R., von Krosigk, M., Christmann, D., Klussmann, J.P., Zietzer, A., Breitrück, N., Jansen, F. and Jansen, S., 2022. Analysis of nocturnal, hypoxia-induced miRNAs in sleep apnea patients. Plos one, 17(3), p.e0263747. IF. 3.24 (2022).
Militello, G., Hosen, M.R., Ponomareva, Y., Gellert, P., Weirick, T., John, D., Hindi, S.M., Mamchaoui, K., Mouly, V., Döring, C. and Zhang, L. A novel long non-coding RNA Myolinc regulates myogenesis through TDP-43 and Filip1. Journal of molecular cell biology, 2018;10(2):102-117. IF. 6.595 (2018).
Zietzer, A., Al-Kassou, B., Hosen, M.R., Goody, P.R., Tiyerili, V., Zimmer, S. and Schrickel, J.W., 2021. Large extracellular vesicles in the left atrial appendage in patients with atrial fibrillation—the missing link?. Clinical Research in Cardiology, pp.1-16. IF. 5.862 (2021).
Hosen, M.R.*#, Militello, G., Weirick, T., Ponomareva, Y., Dassanayaka, S., Moore IV, J.B., Döring, C., Wysoczynski, M., Jones, S.P., Dimmeler, S. and Uchida, S. Airn regulates Igf2bp2 translation in cardiomyocytes. Circulation research, 2018;122(10):1347-1353. IF. 15.862 (2018).
(* First or Co-first author, # Mentoring author, § Principal Investigator, IF, impact factor)
AG Cardiorenal crosstalk and ceramide metabolism in cardiovascular disease
Cardiovascular disease is the number one cause of death in humans worldwide. One of the most important risk factors for the development of vascular and valvular heart diseases is chronic kidney disease. Malfunction of the kidney causes a disruption of the calcium–phosphate homeostasis as well as the accumulation of uremic toxins. Among the latter, indoxyl sulfate, a gut-derived uremic toxin, has been shown to harm endothelial function and to trigger inflammation. One focus of our research group is to investigate the role of kidney disease and in particular of indoxyl sulfate in endothelial injury, aortic valvular calcification and aortic aneurysm formation.
The second focus of our research group is the ceramide metabolism in cardiovascular disease. Ceramides are biologically active sphingolipids that are produced by a complex network of enzymes. Cellular ceramide levels rise in response to hyperglycaemia and TNF-α signalling and are involved in apoptosis and inflammasome activation. In patients, elevated blood ceramide levels are associated with cardiovascular events. In order to influence ceramide-mediated effects, we focus on two target enzymes: Ceramide Synthase 5 and Neutral Sphingomyelinase 2. Our aim is here to identify ways to counteract aortic valve stenosis development as well as to reduce endothelial injury.
In our research projects we perform molecular and cellular studies, transfer these results in animal experiments and confirm our findings human tissues. Thereby we aim to cover the whole translational spectrum from bench to bedside.
Members:
PD Dr. med. Andreas Zietzer
Email: Andreas.Zietzer@ukbonn.de
PD Dr. med. Felix Jansen
Dr. med. Philip Düsing
Dr. med. Ansgar Ackerschott
Cand. med. Daniel Frühwald
Cand. med. Alina Lisanne Jahnel
Cand. med. Laurine Reese
Cand. med. Nadine Heinrich
Ms Paula Levermann
Selected Cooperation Partners
Prof. Dr. Christian Kurts, Institute of Molecular Medicine and Experimental Immunology, University of Bonn.
Dr. Patrick Giavalisco, Max Planck Institute for Biology of Ageing, Metabolomics Core Facility, Cologne.
Dr. Katharina Gutbrod, Prof. Dr. Peter Dörmann Institute of Molecular Physiology and Biotechnology of Plants, University of Bonn.
PD Dr. Reinhard Bauer Life & Medical Sciences Institute (LIMES), Genetics & Molecular Physiology, University of Bonn.
Selected Publications:
Zietzer A, Steffen E, Niepmann S, Düsing P, Hosen MR, Liu W, Jamme P, Al-Kassou B, Goody PR, Zimmer S, Reiners KS, Pfeifer A, Böhm M, Werner N, Nickenig G, Jansen F. MicroRNA-mediated vascular intercellular communication is altered in chronic kidney disease. Cardiovasc Res. 2022 Jan 7;118(1):316-333. (IF 14.239, 2021)
Düsing P, Zietzer A, Goody PR, Hosen MR, Kurts C, Nickenig G, Jansen F. Vascular pathologies in chronic kidney disease: pathophysiological mechanisms and novel therapeutic approaches. J Mol Med (Berl). 2021 (IF 5.606, 2021)
Zietzer A, Nickenig G, Jansen F. Small blebs, big potential – can extracellular vesicles cure cardiovascular disease? Eur Heart J. 2022 Jan 13;43(2):95-97. (IF 35.855, 2021)
Düsing P, Zietzer A, Jansen F. MicroRNA-Based Diagnostics in Heart Diseases: Current Limitations and Future Perspectives. JACC Basic Transl Sci. 2021 Nov 22;6(11):897-899. (IF 9.531, 2021)
Zietzer A, Jahnel AL, Bulic M, Gutbrod K, Düsing P, Hosen MR, Dörmann P, Werner N, Nickenig G, Jansen F. Activation of neutral sphingomyelinase 2 through hyperglycemia contributes to endothelial apoptosis via vesicle-bound intercellular transfer of ceramides. Cell Mol Life Sci. 2021 Dec 24;79(1):48: (IF 9.234, 2021)
Zietzer A*, Hosen MR*, Wang H, Goody PR, Sylvester M, Latz E, Nickenig G, Werner N, Jansen F. The RNA-binding protein hnRNPU regulates the sorting of microRNA-30c-5p into large extracellular vesicles. J Extracell Vesicles. 2020 Jul 2;9(1):1786967. (IF 25.841, 2020)
Zietzer A, Düsing P, Reese L, Nickenig G, Jansen F. Ceramide Metabolism in Cardiovascular Disease: A Network With High Therapeutic Potential. Arterioscler Thromb Vasc Biol. 2022 Oct. (IF 10.514, 2021)
Hosen MR*, Goody PR*, Zietzer A*, Xiang X, Niepmann ST, Sedaghat A, Tiyerili V, Chennupati R, Moore JB 4th, Boon RA, Uchida S, Sinning JM, Zimmer S, Latz E, Werner N, Nickenig G, Jansen F. Circulating MicroRNA-122-5p Is Associated With a Lack of Improvement in Left Ventricular Function After Transcatheter Aortic Valve Replacement and Regulates Viability of Cardiomyocytes Through Extracellular Vesicles. Circulation. 2022 Jul 8. (IF 39.92, 2021)
Zietzer A*, Al-Kassou B*, Jamme P, Rolfes V, Steffen E, Bulic M, Hosen MR, Goody PR, Tiyerili V, Zimmer S, Schrickel JW, Sedaghat A, Franklin BS, Werner N, Nickenig G, Jansen F. Large extracellular vesicles in the left atrial appendage in patients with atrial fibrillation-the missing link? Clin Res Cardiol. 2022 Jan;111(1):34-49. (IF 6.138, 2021)
Pubmed:
Funding:
German Research Foundation
BONFOR program of the medical faculty of the university of Bonn,
German cardiological Society
Ernst & Bertha Grimmke Foundation
European society of cardiology
German heart foundation
Arbeitsgruppe Experimentelle Elektrophysiologie
AG Experimentelle Elektrophysiologie
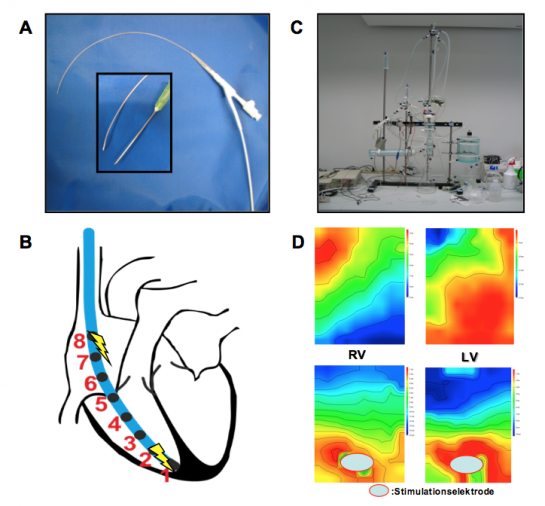
Herzrhythmusstörungen haben einen beträchtlichen Anteil an der kardiovaskulären Morbidität in Deutschland, wobei die Entstehungsmechanismen dieser komplexen Krankheitsbilder bisher nur unzureichend geklärt sind. In der Arbeitsgruppe „Experimentelle Elektrophysiologie“ werden die Leitungseigenschaften des Herzens im Kleintiermodell (Maus) untersucht, um die Mechanismen von Herzrhythmusstörungen der Vorhöfe und Hauptkammern genauer zu verstehen.
Hierbei findet die invasive elektrophysiologische Untersuchung der Maus mittels transvenöser, rechtskardialer Katheterisierung Anwendung. Diese ermöglicht einerseits die valide Prüfung sämtlicher relevanter Parameter der atrialen, AV-nodalen und auch ventrikulären Erregungsleitung sowie andererseits über die elektrische Vorhof- und Hauptkammerstimulation eine atriale und ventrikuläre Vulnerabiltiätsprüfung (Vorhofflimmer-, respektive Kammertachykardie-Induktion) (Abbildung A und B). Die kardialen Leitungseigenschaften können darüber hinaus im Langendorff-perfundierten Mausherz ex vivo mittels Epikardialem Mapping charakterisiert werden (Abbildung C und D).
Tierexperimentell kommen verschiedene pathologische Modelle zur Anwendung (z.B. Kryo-Infarkt, LAD-Ligatur, Angiotensin-induzierte Hypertonie, transverse aortale Konstriktion (TAC)).
Die unserem Labor zur Verfügung stehenden Tiermodelle sowie in und ex vivo Untersuchungen erlauben, gemeinsam mit zusätzlichen molekularbiologischen und (immun-) histochemischen Methoden, in entscheidendem Maße die Einordnung der funktionellen Relevanz zellulärer oder molekularbiologischer Alterationen auf elektrophysiologische Charakteristika im kardiovaskulären System. Einer möglichst genauen Charakterisierung solcher proarrhythmogener Substratfaktoren wird aktuell eine zunehmende Bedeutung in der Entwicklung neuer therapeutischer Strategien in der Arrhythmie-Behandlung zugemessen.
Thematische Schwerpunkte
- Inflammation und Arrhythmien
- Connexine und kardiale Konduktion sowie Arrhythmogenese
- Therapie maligner Arrhythmien nach Myokardinfarkt
- Zelluläre Ersatztherapie
- Medikamentöse Therapie
- Einfluss von myokardialen Strukturproteinen auf die Arrhythmogenese
- Sepsis und Vorhofflimmern
- Einfluss von Hypoxie auf die Genese des Vorhofflimmerns
- Kooperationspartner: Prof. Dr. med. P. Sasse, Institut für Physiologie I, Universität Bonn (Optogenetik zur Therapie von Arrhythmien)
Mitglieder und Kontakte
Priv.-Doz. Dr. med. Thomas Beiert
E-Mail: thomas.beiert@ukbonn.de
Publikationen: www.ncbi.nlm.nih.gov
- Dr. med. Andreas Zietzer
- Dr. med. Christopher Gestrich
- Dr. med. Vincent Knappe
- Dr. med. Maximilian Funken